Всесторонний анализ биоповреждений и создание эколого-технологических основ защиты от биокоррозии на основе обобщения прикладных опытов и результатов фундаментальных исследований актуально, т.к. убытки, причиняемые коррозией металлов огромны.
Основные аспекты ущерба от коррозии металлов [3, 4, 10, 42, 43].
1) экономический аспект проблемы проявляется в непрерывном росте ущерба во времени: например, в США убытки от коррозии в 60-х годах прошлого столетия было на уровне 6–10, в 70-х – более 15, в 80-х – уже 50–82 и в 2004 – 303 млрд. долл. в год, т.е. примерно 3,1 – 4,0 % от ВВП;
2) социальный аспект проблемы не поддается оценкам в стоимостном выражении, но значительна, т.к. проявляются в ущербе памятников культуры, гибелью пассажиров и экипажей космических, воздушных и морских лайнеров из-за биоповреждений;
3) экологический аспект проблемы проявляется во взаимоотношениях человека с окружающей средой: в процессе своей жизнедеятельности человек оснащает биосферу новыми изделиями и конструкциями, одни из них биосфера отторгает и разрушает, другие – вовлекает в искусственные и естественные биоценозы.
В дополнение к вышеизложенному следует отметить, что истинные убытки от коррозии складываются из прямых (стоимость: разрушившейся конструкции, замены оборудования, затраты на мероприятия по защите от коррозии) и косвенных (простои оборудования при замене прокорродировавших деталей и узлов, утечка продуктов, нарушение технологических процессов) потерь [23, 22, 50].
Цель: анализ условий и факторов, влияющих на биокоррозию металлов.
Идея научного теоретического исследования состоит в раскрытии эколого-биологических и технологических закономерностей биокоррозионного процесса в причинно-временной зависимости.
Научная и теоретическая значимость работы: рассмотрение биокоррозионного процесса в аспекте сложной мозаики «конфликтных» взаимоотношений микроорганизмов и металлических конструкций в условиях окружающей среды (грунта, воды, воздуха) могут подсказать пути, с одной стороны, в создании усовершенствованной классификации биокоррозионных явлений, с другой – к поиску новых способов защиты от биокоррозии.
Материалы и методы исследования
Объект исследования: биокоррозионный процесс в наземных, почвенных и водных средах.
Методика исследования. Теоретические исследования были проведены согласно методике, изложенной в ГОСТ [8] и методическим рекомендациям, изложенных в учебном пособии Шкляр М.Ф. [24].
Результаты исследования и их обсуждение
Разрушение металлов и сплавов в результате химического и электрохимического взаимодействия с окружающей средой называют коррозией [16, 20, 68, 69]. В общем случае это разрушение любого материала, будь то металл или керамика, дерево или полимер.
Среда, вызывающая коррозию, является коррозионной (агрессивной). Продуктом коррозии является металл, перешедший в окисленное состояние [1, 41]. Процесс коррозии зависит от факторов внутренних (влияние на вид и скорость коррозии природы металла) и внешних (влияние состава коррозионной среды и условий протекания коррозионного процесса) [16, 37, 56].
Более всего подвержены коррозии чистые металлы. Сплавы, пластики и прочие материалы в этом отношении характеризуются термином «старение». Вместо термина «коррозия» также часто применяют термин «ржавление» [44, 49].
Коррозионный фактор зависит от природы металла. Известны различные классификации коррозии в зависимости от окружающей среды, от условий использования коррозирующих материалов (постоянный или переменный контакт; находятся ли они под напряжением; контактируют ли с другой средой) и от множества других факторов [43, 47].
Почти все металлы, приходят в соприкосновение с окружающей их газообразной или жидкой средой, более или менее быстро подвергаются с поверхности разрушению. Причиной его является химическое взаимодействие металлов с находящимися в воздухе газами, а также с водой и растворенными в ней веществами [20, 46].
Из литературных источников [1, 16, 20, 29, 55, 56] известно, что классификация коррозионных процессов определяется: 1) механизмом процесса; 2) видом агрессивных сред; 3) условиями протекания коррозионного процесса; 4) характером изменения металла или сплава.
В первом случае различают: химический коррозионный процесс (процессы окисления металла и восстановления окислительного компонента среды протекают синхронно). Если поверхность металла соприкасается с коррозионно-активной средой, и при этом нет электрохимических процессов, то имеет место химическая коррозия. Например, образование окалины при взаимодействии металлов с кислородом при высоких температурах; электрохимический коррозионный процесс (ионизация атомов металла и восстановление окислительного компонента среды протекают не в одном акте и их скорости зависят от электродного потенциала). Коррозировать могут два различных металла, соединенных между собой, если на их стык попадет, например, конденсат из воздуха. У разных металлов различные окислительно-восстановительные потенциалы и на стыке металлов образуется фактически гальванический элемент. При этом металл с более низким потенциалом начинает растворяться, в данном случае, коррозировать. Это проявляется на сварочных швах, вокруг заклепок и болтов. Для защиты от такого вида коррозии применяют, например, оцинковку. В паре металл-цинк коррозировать должен цинк, но при коррозии у цинка образуется оксидная пленка, которая сильно замедляет процесс коррозии.
Во втором случае – по типу агрессивных сред, в которых протекает процесс разрушения, коррозию различают: газовую (в газовой среде при влажности 0,1 %); атмосферную (в атмосфере воздуха или любого влажного газа); подземную (в почвах, грунтах); биокоррозионную (под влиянием жизнедеятельности микроорганизмов); контактную (при контакте металлов с разными стационарными потенциалами в данном электролите: коррозия в неэлектролитах; коррозия в электролитах); радиационную (под действием радиоактивного излучения); под током (возникает под воздействием тока от внешнего источника или коррозия под воздействием блуждающих токов) и напряжением (под одновременным воздействием коррозионной среды и механических напряжений); кавитацию (под одновременным коррозионным и ударным воздействием внешней среды) и фреттинг (под одновременным коррозионным и вибрационным воздействием внешней среды) коррозию.
В третьем случае – по условиям протекания различают следующие виды коррозионного процесса: сплошной (охватывается коррозией вся поверхность металла); структурно-избирательный (разрушается одна структурная составляющая или одни компонент сплава); локальный (отдельные участки поверхности металла: питтинг, т.е. точки и «язвы» глубоко проникают в металл, пятна – не сильно углубляются в толщу металла); подповерхностный (распространяется в глубине и приводит к расслоению металлоконструкций); межкристаллический (неэлектрохимическое межкристаллическое локальное разрушение по границам зерен металла; процесс быстротечный с продвижением в глубь) и щелевой (разрушение под прокладками, в зазорах, резьбовых креплениях) коррозионный процесс [16, 18, 20, 53, 54, 56, 58].
Часто к коррозионным процессам третьего типа относят: контактную коррозию; коррозию при неполном погружении; коррозию при полном погружении; коррозию при переменном погружении; коррозию при трении; коррозию под напряжением.
В четвертом случае – по характеру разрушения различают: сплошную коррозию, охватывающую всю поверхность: равномерную; неравномерную; избирательную; локальную (местная) коррозию, охватывающую отдельные участки: пятнами; язвенную; точечную (или питтинг); сквозную; межкристаллитную (расслаивающая в деформированных заготовках и ножевая в сварных соединениях) [40, 58].
В работе Stricher M. (1974) [58] отмечено, что металл (на примере стали в морской воде) корродирует со скоростью 0,13 мм/год или 2,5 г/(м2•сут). Сокол И.Я. и др. (1989) [18] обратили внимание на то, что при питтинге железо корродирует в почве с образованием мелких язв, нержавеющая сталь в морской воде и при быстром потоке жидкости – глубоких язв, растрескивание металлоконструкций происходит в агрессивной коррозионной среде при постоянном растягивающем напряжении, при этом на долю последних приходится 20-40 % всех коррозионных разрушений в энергетике, химической и нефтехимической отраслях промышленности.
Технологически установлено, что металлоконструкции работают в агрессивных средах (до 40-50 %), в слабо агрессивных (до 30 %) и примерно 10 % не требуют активной антикоррозионной защиты. Наибольшие потери от коррозии приходятся на топливно-энергетический комплекс, химию и нефтехимию, сельское хозяйство [16; 28].
На коррозионные исследования влияют ресурсосберегающие (сохранность металлического фонда), технологические (повышение надежности металлоконструкций) и экономические (снижение затрат на возмещение потерь) факторы. Подсчитано, что ежегодно 20-25 млн. т. металла теряется безвозвратно вследствие коррозии [5], при этом общая сумма коррозионных потерь в мире составляет примерно 2-5 % валового национального продукта [17].
Главным рабочим металлом является железо и его сплавы. Механизм образования коррозии [25, 51]: на полированной поверхности малоуглеродистой стали при обычных температурах в чистом сухом воздухе возникает оксидная тонкая защитная пленка, но в присутствии в воздухе, воде и почве электролитов разрушается:
Анодная реакция: Fe>Fe2+ + 2e-; Катодная в деаэрированных растворах: 2H+ + 2e- > H2.
Катодная реакция быстро протекает в кислотах; медленно – в щелочных и нейтральных растворах, а в присутствии кислорода в них идет реакция: O2 + 2H2O + + 4e- > 4OH-. При взаимодействии ионов ОН- и Fe2+ образуется гидрат закиси железа: Fe2+ + 2ОН- > Fe(ОН)2. Последний окисляется до простой формы ржавчины – гидрата окиси железа Fe(ОН)3. Окончательный продут – бурая ржавчина Fe2O3•H2O имеет целый ряд модификаций.
В анаэробных условиях в присутствии сульфатвосстанавливающих бактерий почвы и воды (Desulphovibrio desulphuricans) анодная реакция остается без изменения, тогда как катодная проходит сложнее и приводит она к восстановлению неорганических сульфатов до сульфидов и образованию ржавчины и сульфида железа (FeS).
В табл. 1 представлена зависимость коррозионных свойств сплавов на основе железа.
Таблица 1
Зависимость коррозионных свойств от состава металла: сплавы на основе железа [25]
|
Легко поддаются коррозии |
Поддаются коррозии |
Не поддаются коррозии |
|
Обычные чугуны, стали без легирующих добавок, сварочное железо |
Низколегированные стали (содержат 2-3 % Cu, Cr, Ni) |
Нержавеющие стали с высоким содержанием легирующих добавок (18 % Cr, 8 % Ni, 3 % Mo) |
В дополнение к табл. 1 следует отметить, что коррозия незащищенной поверхности стали в атмосфере, определяется влажностью (70-80 % является критической) и степенью загрязненности воздуха двуокисью серы (например, в промышленных зонах), хлоридами (например, вблизи морского побережья коррозия может протекать и при 40 % влажности) и солями аммония. Скорость протекания коррозионного процесса находится, по оценкам разных авторов [25, 39, 50], в интервале 0,005-0,950 мм/год.
Коррозия стали в водных средах обусловлена такими факторами, как состав стали и состояние ее поверхности (сварочное железо более стойка, чем малоуглеродистая сталь; для повышения стойкости стали в водных средах рекомендуют вводить более 3 % легирующих добавок, например, хрома; скорость коррозии сварных швов на ледоколах может достигать в морской воде 10 мм/год), свойства воды (природа воды, количество растворенных твердых веществ: хлориды и сульфаты усиливают процесс электрохимической коррозии; рН: кислая среда более агрессивна, менее щелочная, но в шелочной образуется питтинг; жесткость: жесткие водные среды менее агрессивны; содержание двуокиси углерода, которая влияет на кислотность воды и на образование защитной карбонатной окалины, и кислорода, критическая концентрация последнего 12 моль/л; наличие органических веществ: торф, делая воду кислой, усиливает коррозию; сульфатвосстанавливающие бактерии коррозируют металл, дополнительно процесс усиливают в морской воде ракушки вследствие обрастания судна, в пресной – водоросли), условия эксплуатации (температура: при повышении скорость коррозионного процесса увеличивается; скорость потока: в морской воде из-за высокой концентрации хлоридов скорость коррозии возрастает с увеличением скорости потока, в среднем 0,12-0,83 мм/год; особенности конструкции; блуждающие токи) [12, 14, 15, 19, 25, 26, 39, 52, 56].
Коррозия стали в почве зависит от условий эксплуатации (сильные коррозионные процессы происходят в местах выхода тока из металла, это происходит либо, когда трубопроводы проходят по участкам с различными грунтами, что приводит к образованию коррозионных токов дифференциальной аэрации, либо по трубопроводу протекают блуждающие токи от близлежащих электрических коммуникаций), состава металла (подземная коррозия имеет, в основном, электрохимический характер и протекает со скоростью, в среднем 0,035-0,050 мм/год; питтинговая коррозия 0,25-30 мм/год), вид почвы (сухие песчаные или известковые почвы с высоким электросопротивлением наименее, глинистые и сильно соленые почвы наиболее агрессивны) [2, 9, 25, 31, 56].
Коррозия цветных металлов и сплавов. Вследствие коррозии ежегодно разрушается такое количество стали, которое приблизительно равно ¼ всей мировой выработки [9, 13, 20, 48].
Высокая коррозионная стойкость алюминия и алюминиевых сплавов обеспечивается образованием на металле в считанные секунды защитной окисной пленки толщиной примерно 10 A, дальнейшее увеличение толщины зависит от окружающей среды: ускоряется при повышении температуры и влажности. Коррозия алюминия чаще всего проявляется в некоторых нейтральных растворах в виде электрохимического питтинга на различных дефектах и далее распространяется вследствие того, что внутри питтинга раствор окисляется. Для алюминия, растворы, содержащие хлориды, да еще с действием локальных гальванических ячеек, агрессивны. Межкристаллическая электрохимическая коррозия вызывается какой-либо неоднородностью структуры сплава, вызванной легирующими добавками или малыми количествами примесей. Например, в сплавах Al-Cu, если не были соблюдены правильная технология производства и не был выбран правильный режим термообработки, то на границах зерен частиц CuAl2 соседние области твердого раствора становятся анодными и, следовательно, склонными к коррозии. Для высокопрочных сплавов системы Al-Zn-Mg-Cu и Al-Mg (деформируемых и литейных) с повышенным Mg-содержанием характерна межкристаллическая коррозия под напряжением. В материалах с волокнистой структурой медьсодержащих сплавов, образованные под прокаткой или прессованием, могут возникнуть частично разделенные слои, которые и представляют собой одну из форм коррозионного растрескивания. Такие легирующие элементы и примеси, как Cu повышают чувствительность к межкристаллической и общей коррозии (Cu-содержащие алюминиевые сплавы менее коррозионностойкие). Но сплав Al-Zn-Cu имеет повышенную стойкость к коррозии под напряжением. Mg-содержащие (до 5 %) алюминиевые сплавы коррозионностойки в морской воде. При контакте Al с другими металлами между ними может возникнуть разность потенциала и ток, приводящие к контактной коррозии, например, в морских водах контакты меди с латунью и бронзой, в воде свинца и алюминия ускоряет коррозию алюминия. Также для алюминия неблагоприятен контакт со ртутью и всеми драгоценными металлами [6, 20, 28, 56].
Агрессивными для алюминия являются морские среды и промышленные атмосферы с большим количеством кислых газов, например, с двуокисью серы, хлориды и кислые сульфаты совместно с сыростью скорость коррозии усиливают, образуя очень объемные и рыхлые продукты коррозии [6, 7, 56].
В жесткой воде концентрация 0,02 мг/л Cu приводит к питтинговой коррозии алюминия [6, 7, 56].
Коррозия в почве определяется влажностью, способной вымывать растворимые составляющие. Агрессивными по отношению к алюминиевому сплаву является насыпной грунт, содержащий шлак. В растворах солей тяжелых металлов (серебро, медь, золото) на поверхности металла образуется контактная коррозия [6, 7, 11, 56].
Медь и медные сплавы подвержены селективным формам коррозии (наименее стойки коррозии латуни: обесцинкование или сезонное растрескивание, ударная коррозия в мягкой воде с быстрым потоком и большим содержанием свободной двуокиси углерода, хлоридов и сульфатов, питтинг в скважинах с холодной водой, в медных водяных цилиндрах). Торф (рН 2,6), шлак (рН 7,6) и болотистый грунт в зоне прилива (рН 6,9) являются наиболее агрессивными для медных сплавов [6, 7, 47, 56].
Свинец и свинцовые сплавы берегут от контакта с дистиллированной водой. Хотя в них коррозия свинца невелика, но ее скорость возрастает в присутствии кислорода, двуокиси углерода. Дождевая вода способна растворять свинец. Застойные воды, содержащие нитраты, двуокись углерода также вызывают коррозию свинца. Подземные металлические конструкции являются причиной повреждения подземных конструкций (свинцовые трубы, оболочки кабелей) [6, 7, 66].
Микроорганизмы – источники биокоррозии. Особый интерес для исследования представляет биокоррозия микробиологической природы.
Микроорганизмы коррозируют металл после определенного периода адаптации, необходимого для образования колоний и консорциума [6, 7, 27, 56]:
– специфически, т.е. когда микроорганизмы материалы конструкции потребляют в качестве источников питания (биохимическая коррозия),
– косвенно, т.е. когда продукты жизнедеятельности микроорганизмов повышают агрессивность среды и стимулируют процессы коррозии металлов (электрохимическая коррозия трубопроводов, связанная с жизнедеятельностью железобактеерий).
Бактерии и грибы – источники биокоррозии. Бактерии, участвующие в коррозии металлов, в основном, относятся к хемотрофам (рис. 1).
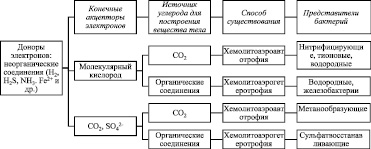
а) доноры электронов: неорганические соединения (Н2, Н2S, NH3. Fe2+ и др.)
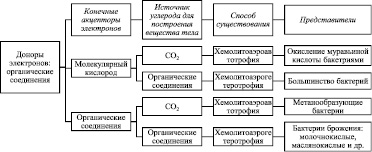
Рис. 1. Способы существования хемотрофов (по М.В. Гусеву, Л.А. Минеевой, 1978) [10, 56, 61]
Как видно из рис. 1:
1) наиболее активными литотрофными агентами биокоррозии являются сульфатредуцирующие (десульфатирующие), нитрифицирующие, тионовые и железобактерии;
2) биокоррозионные процессы протекают благодаря тому, что многие бактерии могут:
а) существовать без использования органических веществ из среды;
б) адсорбироваться на поверхности металлических конструкций;
в) сохранять жизнеспособность в экстремальных условиях среды:
– при высокой температуре: для хемолитотрофных и гетеротрофных бактерий температурный предел роста может превышать 90 °С (например, активные возбудители биокоррозии Thiobacillus, сульфатредуцирующие характеризуются высокой термостойкостью своих белков, ферментов и липидов их мембран (липиды много содержат насыщенных и разветвлённых жирных кислот с большим числом атомов углерода),
– при высоком давлении (сульфатредуцирующие бактерии были выделены из нефтяных скважин на глубине 3500 м и более при температуре до 105 °С и давлении 400 атм и более):
– при сильной кислотности (рН = 1) или щелочности (рН = 10) растут Thiobacillus;
– при больших концентрациях солей (археи галофилы);
– при интенсивном облучении, например, некоторые виды Pseadomonas.
В дополнение к рис. 1 приводятся табл. 2, где расписаны экологические аспекты для возбудителей биокоррозии металлов – литотрофных бактерий.
Таблица 2
Литотрофные бактерии – возбудители биокоррозии [10, 21, 30, 32, 33, 45, 56, 57]
|
Показатель |
Краткая характеристика литотрофных (коррозийных) бактерий |
||
|
сульфатредуцирующие |
тионовые |
железобактерии |
|
|
Распространение |
В почве, в воде (пресной, соленой), геологических отложениях серы и нефти |
В водах (пресных и соленых), в серных источниках с невысоким содержанием H2S |
В почве, воде, железосодержащих рудах |
|
Представители (роды) |
Desulfovibrio (неспоровые грамотрицательные подвижные, клетки с разными типами кривизны): D. africans (монополярный политрих), D.desulfuricans, D. vulgaris, D. salexigenes (монополярные монотрихи). Desulfotomaculum (перитрихи: термофил Dtm. Nigrificans (развивается в системах центрального отопления, теплообменниках), Dtm. Orientis: эндоспоровые грамотрицательные прямые или изогнутые палочки, иногда образующие цепочки). Первый род обнаруживается преимущественно в воде, второй – в почве. |
Thiobacillus (неспорообразующие грамотрицательные палочки; некоторые подвижны за счет полярно расположенных жгутиков). По отношению к кислотности среды: при нейтральной среде (T. Thioparus, T. denitrificans), при кислой (рН 0,5-3,5) – ацидофилы: T. thiooxidans, T. ferrooxidans, T. acidophilus Растут в присутствии молекулярного кислорода; имеются факультативные анаэробы |
Представители нитчатых бактерий, цианобактерии, флексибактерии, микроплазмы. Различают две группы: облигатно ацидофильные хемолитоавтотрофы (T. ferrooxidans, Leptospirillum ferrooxidans); Растущие в слабощелочной и нейтральной среде |
|
Акцепторы электронов |
Сульфат, сульфит, тиосульфит, тетратионат. Конечным продуктом анаэробного дыхания является сероводород |
О2 служит конечным акцептором электронов |
Доноры электронов: Fe2+ |
|
Особенность |
Возбудители анаэробной коррозии железа, стали и алюминия |
в отсутствие молекулярного водорода хорошо растут на органических средах |
Окисляют восстановленные формы железа, откладывают окислы железа на поверхности своих клеток |
|
Механизм вызываемой коррозии |
1) стимуляция катодной деполяризации твердыми сульфидами железа; 2) вследствие потребления поляризованного водорода |
Осуществляют окисление различных восстановительных соединений серы до сульфатов |
Образуют дифференцированно аэрируемые ячейки (слизистые скопления) на поверхности коррозируемого субстрата |
|
Основной ущерб |
Газо- и нефтетрубопроводы, стальные хранилища нефти, трубопроводы и градирни обратного водоснабжения, железобетонные стены подводных тоннелей |
Металлические конструкции, каменные и бетонные сооружения, резиновые изделия |
Металлические конструкции всех видов |
|
Особенность «функционирования» |
Образуют часто ассоциации с аэробными слизеобразующими микроорганизмами, которые создают для первых анаэробные условия |
Окисляют с получением энергии: сера (S-), H2S, тиосульфат (S2O32-), тритионат (S3O62-), тиоционат (CNS-) |
Источником энергии для первых служит процесс окисления закисного железа; источником углерода –СО2, для вторых – окисление Fe2+ происходит при реакции с Н2О2 или с участием каталазы |
|
Условия роста некоторых культур |
От 3-5 до 35-104 °С; рН 4,2-10,5; до 1000 атм |
8-75 °С; рН 0,5-3,5 |
- |
Как видно из табл. 2, к литотрофным бактериям, вызывающих биокоррозию, относят сульфатредуцирующие, нитрифицирующие, тионовые и железобактерии. При этом, последняя группа – это не таксономическая, а экологическая.
Литотрофные бактерии (Pseudomonas) получают энергию для своей жизнедеятельности за счет превращения неорганических веществ. Биокоррозия возникает за счет выделения литотрофами агрессивных метаболитов (аммиак, органические кислоты, сероводород и др.) [10, 34, 56].
В основе биокоррозионного действия, безусловно, находятся ферментативные процессы, регулируемые, в основном, такими ферментами, как оксидоредуктазами и гидролазами [6, 7, 35, 56, 57]. Ферментативная активность проявляется в водной среде, при этом вода, достаточная для коррозионного процесса, может вноситься самим микроорганизмом.
Классификация биокоррозии металлов представлена на рис. 2 [14, 56].
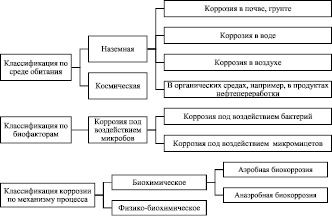
Рис. 2. Классификация биокоррозии металлов [14, 56]
Как видно из рис. 2, коррозия классифицируется по среде обитания микроорганизмов, по природе микроорганизмов и по механизму протекания коррозионного процесса.
Аэробная биокоррозия протекает под действием тионовых, нитрифицирующих и железобактерий в присутствии растворенного О2. Метаболизм тионовых и нитрифицирующих бактерий приводит к созданию агрессивных коррозионных сред за счет накопления конечных продуктов – серной и азотной кислот, а железобактерий – образует дифференцированно аэрируемые ячейки. Анаэробная биокоррозия – это результат действия сульфатредуцирующих бактерий рода Desulfovibrio и Desulfotomaculum, ответственных за восстановление сульфатов до сероводорода [10, 36, 56].
Биокоррозионное действие может привести к отказу конструкции. Например, ходовые части кораблей снижаются вследствие обрастания и биокоррозии, что приводит к перегреву и преждевременному износу систем и двигателей [6, 7, 12, 56].
Исследования показали, что до 65-70 % применяемых металлоконструкций не обладают достаточной стойкости к микроорганизмам и до 50 % коррозионных процессов связано с микробиологической активностью [15, 56].
Агрессивное, по отношению к металлоконструкциям, влияние бактерий (сульфатвосстанавливающие и тионовые бактерии, железобактерии) и мицелиальных грибов (микромицеты) проявляется при аэробных и анаэробных условиях. Поэтому биокоррозии могут иметь бактериальное, микромицетное и смешанное происхождение [10, 56, 67].
Таким образом, агентами биокоррозии металлоконструкций являются грибы родов Cladosporium, Aspergillus, Fusarium, Penicillium, сульфатвосстанавливающие бактерии (СВБ) родов Desulfovibrio, тионовые бактерии рода Thiobacillus, окисляющих серу и соединения серы до серной кислоты; железобактерии рода Gallionella, окисляющих закисное железо до окисного.
Биохимические механизмы бактериальной коррозии металлов вкратце описаны ниже.
Облигатно анаэробные сульфатредуцирующие бактерии используют сульфат (конечный акцептор электронов) для образования H2S (диссимиляторная сульфатредукция: для активации одной молекулы сульфата требуется одна молекула АТФ) [10, 56, 59]:
SO42- + 8e + 10H+ > H2S + 4 H2O.
Фермент аденозин-5’-фосфосульфатредуктаза восстанавливает аденозинфосфосульфат до сульфата и АМФ [56, 59, 64, 65]:
SO42- + АТФ 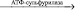 АФС (аденозинфосфосульфат) + пирофосфат
АФС (аденозинфосфосульфат) + пирофосфат
АФС + 2е 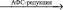 SO32- + АМФ
SO32- + АМФ
SO32- + 6е + 8Н+ > H2S + 3 H2O
Особенность сульфатредуцирующих бактерий при механизме биокоррозии: не способны к автотрофной ассимиляции углекислоты и для размножения нуждаются в готовых органических веществах. В качестве доноров электронов (водорода) для них служат конечные продукты брожения (лактат, малат, этанол окисляются до ацетата и углекислого газа) других видов микроорганизмов, Так, в глинистых почвах в анаэробных условиях водопроводные трубы с толщиной стенки 6 мм разрушаются полностью в течение 3-4 лет [10, 56, 60, 65].
Тионовые бактерии окисляют восстановленные соединения серы (сульфиды и др.) до сульфатов (скорость тионового окисления в миллионы раз выше химического). Метаболизм тионовых бактерий, с одной стороны, для биокоррозии образует агрессивную среду за счет продуцирования серной кислоты, н с другой, окисляет закисное сернокислое железо до окисного. Последний обладает агрессивностью к металлическим конструкциям. Окисное железо, принимая электроны с поверхности металлической конструкции, восстанавливается до закисного, после чего последний опять окисляется сульфатредуцирующими бактериями до окисного. В результате, постоянно образуется окисное железо и разрушается металлическая конструкция [10, 56, 62].
Нитрифицирующие бактерии окисляют аммиак до нитратов: NH4+ > NO2- > NO3-. Образующаяся азотная кислота агрессивно вызывает коррозию металлов. Нитрифицирующие бактерии создают кислые агрессивные среды в помощь другим биокоррозионным таксонам. В процессе нитрификации образуется азотная кислота за счет окисления аммиака. Представители Nitrosomonas, Nitrosocystis стимулируют первую фазу нитрификации: NH3 + 1,5 O2 = = HNO2 + H2O + 73 ккал., а Nitrobacter vinogradskii – вторую фазу: HNO2 + 0,5 O2 = = HNO3 + 17 ккал [10, 56, 63].
Железобактерии корродируют металлические конструкции, соприкасающиеся с водой. На месте сварных швов образуются благодаря железобактериям, слизистые скопления, омываемые водой (катод), под которыми образуются дифференцированно аэрируемые ячейки (анод). В анодной зоне металл корродирует: Fe 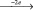 Fe2+. Ионы Fe2+ на аноде образуют Fe(OH)2, который окисляется до Fe(OH)3, который в свою очередь на аноде усиливает его анаэробность, увеличивает разность потенциалов, ускоряет биокоррозию [10, 38, 56, 61].
Fe2+. Ионы Fe2+ на аноде образуют Fe(OH)2, который окисляется до Fe(OH)3, который в свою очередь на аноде усиливает его анаэробность, увеличивает разность потенциалов, ускоряет биокоррозию [10, 38, 56, 61].
Способы борьбы с коррозией чрезвычайно разнообразны. Наиболее простой из них заключается в защите поверхности металла от непосредственного соприкосновения с окружающей средой путем покрытия масляной краской, лаком, эмалью, высокомолекулярными пленками тонким слоем другого металла. Кроме цинка из более активных металлов иногда применяют кадмий, действующий подобно цинку. Из менее активных металлов для покрытия стали чаще всего кроме олова используют медь и никель. Никелированные стальные изделия красивы, кроме того, при повреждении слоя никеля коррозия происходит менее интенсивно, чем при повреждении слоя меди или олова, так как разность потенциалов для пары никель-железо гораздо меньше, чем для пары медь-железо [10, 14, 16, 23, 44, 56].
В целом, основные методы борьбы с коррозией представлены на рисунке 3.
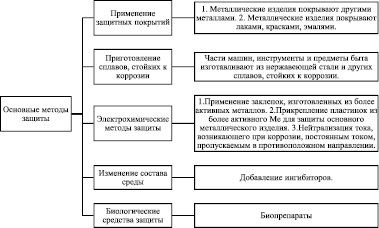
Рис. 3. Методы борьбы с коррозией
Заключение
(Био)коррозия металлов и сплавов (разрушение в результате химического, биохимического и электрохимического взаимодействия с агрессивными условиями окружающей среды) проявляется в ущербе экологическом, социальном и экономическом. Процесс коррозии зависит от факторов внутренних и внешних. Продуктом коррозии является металл, перешедший в окисленное состояние.
Технологически установлено, что:
– металлоконструкции в промышленных условиях функционируют в средах, различающиеся по степени агрессивности: в агрессивных до 40-50 % от всех используемых металлических сооружений и конструкций, в слабо агрессивных – до 30 % и в неагрессивных – примерно 10 %. Наибольшие потери от коррозии приходятся на топливно-энергетический комплекс, химию и нефтехимию, сельское хозяйство. Классификация коррозионных процессов определяется механизмом процесса, видом агрессивных сред, условиями протекания коррозионного процесса и характером изменения металла или сплава;
– до 65-70 % применяемых металлоконструкций не обладают достаточной стойкости к микроорганизмам и до 50 % коррозионных процессов связано с микробиологической активностью.
Выводы:
1) биокоррозии могут иметь бактериальное, микромицетное и смешанное происхождение;
2) агентами биокоррозии металлоконструкций, в основном, являются:
– грибы родов Cladosporium, Aspergillus, Fusarium, Penicillium,
– сульфатвосстанавливающие бактерии родов Desulfovibrio, тионовые бактерии рода Thiobacillus,
– железобактерии рода Gallionella;
3) агрессивное влияние бактерий (сульфатвосстанавливающие и тионовые бактерии, железобактерии) и мицелиальных грибов (микромицеты) к металлоконструкциям проявляется при аэробных и анаэробных условиях.
 science-review.ru
science-review.ru